培养瓶中贴壁细胞操作步骤:
对于贴壁培养的细胞,寄送前,我们会将培养基充满整个培养瓶 (运输培养基),以减少产品运输过程中贴壁细胞的脱落。
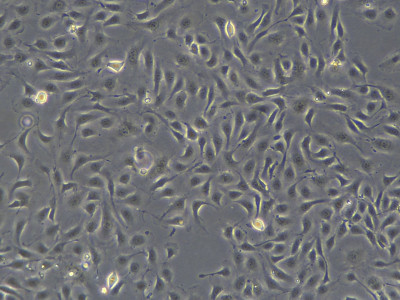
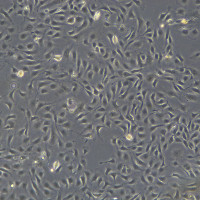
1. 收到细胞产品后,请及时核对培养瓶上标注的细胞名称与订 购的细胞名称是否一致,培养瓶是否有破损或漏液等异常情况。 将培养瓶置于倒置显微镜下仔细观察是否浑浊、是否细菌污染,有条件的情况下拍照并保存。因在运输过程中存在颠簸,且有些 细胞对温度变化也很敏感,可能存在一些细胞脱落漂浮的情况,这些细胞仍是活细胞,请勿丢弃,可离心富集后传代使用。如发现问题请及时联系售后。 2. 如没有发现污染等异常情况,用70%酒精擦拭培养瓶表面后,将培养瓶放置37℃、5% CO2培养箱,静置1-2小时,镜下观察,若细胞汇合<90%,在生物安全柜环境中,去除培养瓶中的多余培养基,加入新鲜培养液5-8ml,随后将细胞置于 5%CO2 的恒温培养箱中培养。如果细胞已经长满培养瓶,请立即传代。冻存细胞操作步骤:注意:为保证细胞的高存活率,请收到产品后,立即将细胞冻存管转入液氮并长期保存,直到需要复苏用于实验。使用Tissue culture treated 培养瓶或培养皿。 1. 将冻存管置于37℃ 水浴中来回晃动,迅速解冻。为避免污染,确保冻存管口置于水面之上。解冻需迅速,大约2分钟。 2. 一旦冻存管中液体融化后,立即取出,采用70%酒精喷拭冻存管表面。从此步开始,后续操作须在生物安全柜中完成。 3. 将冻存管中的液体直接转移到含有9mL完全培养基的T25细胞培养瓶中。 4. 将培养瓶置于37℃ 5% CO2培养箱培养 5. 16小时后,将培养瓶中的培养基弃掉,更换新鲜的完全培养基继续培养。 维持培养:1. 从冷冻保存的细胞建立培养后的第二天更换新鲜培养基。2. 此后每三天更换培养基,直到培养皿内的细胞汇合约70%。3. 一旦培养的细胞达到70%汇合度,每隔一天更换培养基,直到细胞约90%汇合。 细胞传代培养:1.吸取并弃掉培养瓶中培养基, 加入PBS清洗2-3次,弃去。2.加入1 mL胰酶细胞消化液(0.05%胰酶+0.02% EDTA),并置于37 ℃培养箱中孵育1-2分钟,至细胞开始皱缩,细胞间隙增大,彼此分离,呈圆形。(此处为25cm^2培养瓶所用体积,可根据实际情况增减用量)。3.孵育期间准备一个15毫升离心管,加入2-3 完全培养基。4.将培养瓶中的胰酶消化液转移至15毫升离心管中,培养瓶继续置于培养箱中孵育,轻拍培养瓶直至所有的细胞脱落分离,向培养瓶中加入2ml完全培养基终止消化,并将脱落的细胞转移到15ml离心管中。5.检查是否成功收获细胞,在显微镜下观察培养瓶,查看残留下的细胞数量少于5%。6.将15ml离心管以1000rpm离心5分钟。弃上清,轻轻地将细胞重悬于新鲜的完全培养基中。7.将细胞转移至表面处理过的培养器皿中,置于37℃ 5% CO2培养箱培养。传代比例:建议收到细胞后的第一次传代比例为1:2,后期可1:3传代,也可根据实验需要进行传代。 细胞冻存液:细胞冻存液,请使用产品: Cryo Frozen Medium(Cat#CTCC-002-002)离心收集细胞后,加入适量冻存液(每管细胞冻存量达到10的6次方),将冻存管放入冻存盒置于负80冰箱,24h后将冻存管转入液氮长期保存。 细胞图:


 细胞鉴定图:
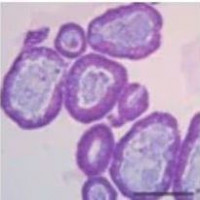
细胞鉴定图: