B-27 Serum-Free Supplement (50×)B-27无血清添加剂产品简介

B-27 Serum-Free Supplement (50×),即 B-27 无血清添加剂(50×) , B-27 是一种最常被引用 的神经细胞培养添加剂,是一种优化的无血清添加剂,用于支持胚胎、出生后和成年海马神经元和其 他中枢神经系统(CNS)神经元的生长和活性维持。B-27 无血清添加剂以 50 倍工作液提供,旨在与神 经基底培养基一起使用,神经基底培养基用于神经细胞培养,无需星形胶质细胞饲养层。
在神经元基础培养基中使用B-27 添加剂,用于培养产前和胚胎神经元,以获得优化的活性和长期 的存活率。
在神经元基础培养基中使用B-27 添加剂,用于培养神经来源的肿瘤细胞系,可有效地保证其活性。
在 DMEM/F12 培养基中添加 B-27 添加剂,已被证明可支持扩增来自小鼠胚胎纹状体和中脑的 EGF 响应性的前体细胞。
B-27 Serum-Free Supplement (50×)B-27无血清添加剂产品信息

B-27 Serum-Free Supplement (50×)B-27无血清添加剂使用说明
1. 完全培养基制备
(1)置于 4℃解冻本产品。
(2)在使用前无菌添加2%本产品和0.5 mM L-谷氨酰胺至神经元基础培养基,配制成神经元完全 培养基(注:下文中出现的“神经元完全培养基 ”即指此种添加了B-27 添加剂和 L-谷氨酰胺的神 经元基础培养基)注意:剩余的本产品可以等分成工作体积,并储存在-30~-5℃。在以后的试验中 根据需要解冻相应体积的本产品。避免反复冻融。
(3)对于原代海马神经元培养,神经元完全培养基(由前述步骤制备)需要额外补充25 μM 的 L-谷氨酸,在培养的第 4 天以后的换液中应不再添加谷氨酸。配置好的完全培养基,可于 2-8℃的 避光保存一周。
2. 细胞培养步骤
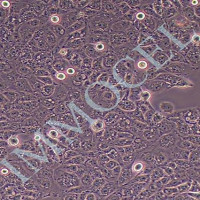
下列步骤已在大鼠胎儿原代海马和皮层神经元,以及神经母细胞瘤细胞系中测试。
(1)用无菌的冷的 0.05 mg/mL 多聚赖氨酸水溶液包被培养表面(玻璃或细胞培养级塑料),每平方 厘米表面使用 0.15 mL,在室温下保温 1 h。
(2)去除多聚赖氨酸溶液,并用无菌蒸馏水冲洗两次(须彻底清洗,因为多聚赖氨酸对细胞有毒性)。 在超净工作台中打开培养板的盖子通风,直到每个孔都完全干燥。培养板干燥后可以立即使用或在 4 °C 最多保存 2 周。
(3)根据标准实验室程序或随细胞提供的说明书分离原代的大鼠神经元或解冻冻存的原代大鼠神 经元。
(4)在预热的(37℃)神经元完全培养基中(如前所述的方法制备)接种细胞,建议的细胞密度为 160 个细胞/mm2 ,或必要时使用自行优化的细胞密度。注意:对于海马神经元,培养基中须添加25 μM L-谷氨酸,参见“完全培养基的制备”。
(5)在 36℃至 38℃ , 含 5%二氧化碳的潮湿环境中培养(使用自然空气也是可接受的,但推荐含 9%氧气和 5%二氧化碳的气体环境)。
(6)培养 4-24 小时后,更换一半体积的新鲜培养基,继续在培养箱中培养。
(7)对海马神经元以外的细胞:在接种4 天后,更换一半体积的新鲜的完全培养基,之后每三天 重复一次。对海马神经元:接种三天后,用不含 L-谷氨酸的新鲜培养基更换一半体积的培养基。
之后每三天重复一次。
3. 分离原代大鼠胚胎神经元
下列程序推荐用于培养受精 18 天的大鼠胚胎海马神经元和大脑皮层神经元。
(1)从受精 18 天的大鼠胚胎中分离大脑皮层和双侧海马。
(2)在预置了Hibernate-E 完全培养基的锥形管中收集所有的组织。放置,直到所有的组织都已 解体。
(3)使组织沉积在管的底部,然后小心地去除上清液, 只留下刚好可覆盖组织的最少量的培养基。
(4)在不含钙离子的 Hibernate-E 培养基中,使用 2 mg/mL 过滤灭菌的木瓜蛋白酶溶液,在 30℃ 酶解组织大约 30 min,其间每5 min 轻摇锥形管以帮助降解。每对海马组织使用2 mL 酶溶液。
(5)加入两倍体积的 Hibernate-E 完全培养基以恢复二价阳离子的浓度,停止酶解。
(6)使未解离的组织沉降至管底(约 2 min),然后把上清液转移到 15 mL 离心管中,以 150×g 离心 5 min。
(7)在 1 mL 神经元完全培养基中重悬沉淀物,取一小份(例如 10 μL)进行细胞计数。后续的操 作按照“复苏和培养冻存的神经元”的第 8-10 步骤进行。
4. 复苏和培养冻存的神经元
重要提示:原代神经元细胞将会贴附在裸露的塑料或玻璃表面,建议事先用神经元完全培养基冲洗 所有的塑料和玻璃器皿的内表面,以获得最高的回收率和产量。由于细胞从冻存状态复苏时极其脆 弱,请在整个操作过程中不要震荡或离心细胞。我们建议每次只解冻一管细胞。务必减少从液氮中 转移冻存管到 37℃水浴中的操作时间。细胞从液氮罐到水浴的运输过程中,可在冰桶中放少量液 氮,将细胞置于这个冰桶中来进行。
(1)在解冻细胞之前,用神经元完全培养基冲洗无菌的 15 mL 锥形管,然后在超净工作台中通风 晾干。
(2)从液氮中取出冻存管时可稍微拧松管帽以释放压力,然后再拧紧。
(3)在 37℃水浴中轻柔搅拌冻存管以快速解冻细胞(小于2 min)。当观察到冻存管中只有很少 量的冰晶存在时(触摸冻存管仍然感觉是冷的)从水浴中取出。
(4)在超净工作台中用 70%的异丙醇消毒冻存管。在工作台台面上轻敲冻存管以使管内液体沉降 到管底。
(5)使用事先用神经元完全培养基冲洗并干燥过的 1 mL 吸头极其轻柔地将细胞转移到事先冲洗并 干燥的 15 mL 锥形管中。
(6)用 1 mL 预热的神经元完全培养基冲洗冲洗冻存管,以每秒一滴的速度极其缓慢地加入到 15 mL 锥形管中的细胞里。每加一滴都轻柔地转动锥形管一次。不要一次即把全部培养基加到锥形管中。
(7)慢慢地逐滴加入另外 2 mL 预热的完全培养基,使管内的液体体积为4 mL。用 1 mL 吸头轻柔地混 合液体,注意不要造成任何气泡。
(8)用一个事先冲洗干燥过的吸头吸取 10 μL 细胞悬液加入到含有 10 μL 0.4%台盼蓝的微量离心管 中,轻敲管壁以混匀溶液。使用手动的细胞计数方法测定活细胞密度。解冻的细胞的活率应超过 50%。
(9)在已经事先用多聚赖氨酸包被(参见“细胞培养步骤 ”)的 48 孔板中每孔中接种大约 1×105 个 细胞或按所需的细胞密度接种。加入预热的神经元完全培养基将细胞悬液稀释到每孔 500 μL。
(10)按照“细胞培养步骤 ”中的5-6 步骤进行神经元的培养。在 36℃至 38℃ , 含 5%二氧化碳的潮湿 环境中培养(使用自然空气也是可接受的,但推荐含 9%氧气和 5%二氧化碳的气体环境)。
注意事项
1.本产品经过严格除菌过滤,为无菌产品,必须在超净台内使用,以避免微生物污染。
2.本产品须尽量避免光照。本产品充分融解并混匀后,如有必要,可以适当分装后-20℃避光保存。短 期内如果频繁使用,可以 4℃避光保存,并建议在 1-2 周内用完。
3.本产品长时间存放可能会出现少量沉淀,可上下颠倒混匀,完全溶解后即可正常使用。
4.本产品仅限于专业人员的科学研究用,不得用于临床诊断或治疗,不得用于食品或药品,不得存放 于普通住宅内。
5.为了您的安全和健康,请穿实验服并戴一次性手套操作。