小鼠肝星状细胞分离试剂盒产品描述
Cat NO: IMP-MK003
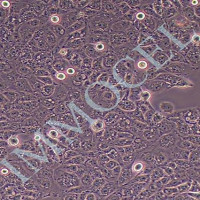
肝星状细胞(Hepatic Stellate Cells, HSCs)是肝脏合成细胞外基质的主要细胞群,肝星状细胞具 有多方面的功能,例如:分泌蛋白多糖、糖蛋白等细胞外基质成分,合成一定量的胶原以维持正常的 基底膜结构,以及通过其突起的收缩参与肝窦的微循环调节。肝损伤导致的 HSCs 的激活、增殖及转 化是肝纤维化过程中的重要环节,因此肝星状细胞在探讨新的抗肝纤维化治疗措施,对降低慢性肝病 的发生率和死亡率具有不可估量的理论意义。试剂盒采用二步灌流法+水浴消化法,结合细胞纯化液 使用可快速纯化得到小鼠肝星状细胞。使用本试剂盒提取所得的小鼠原代肝星状细胞纯度>90.0%,纯 化后可直接进行 RT-qPCR、Western blot 等基本生物学实验,贴壁后可进行药理、病理、毒理学、免 疫染色等实验操作。
小鼠肝星状细胞分离试剂盒适用范围
该试剂盒适用于 C57BL/6J、BALB/c 等不同品系6 周龄以上小鼠的原代肝星状细胞提取试剂盒。
小鼠肝星状细胞分离试剂盒规格
本试剂盒规格为 10 次(以 1 只 6 周龄以上小鼠为 1 次计,约得到 5×105-7×105 个细胞)
小鼠肝星状细胞分离试剂盒运输和存储条件
2-8 ℃保存与运输,保质期为参考下表。所有组分开封后,有效期为 6-8 周,建议尽快使用。
小鼠肝星状细胞分离试剂盒配套培养基信息
表 1. 试剂盒组成信息
产品货号 | 产品名称 | 产品规格 | 储存条件 |
IMP-MK003B | 小鼠肝星状细胞灌注液 Ⅰ | 500 mL | 2-8°C 3 个月 |
IMP-MK003C | 小鼠肝星状细胞灌注液 Ⅱ | 500 mL | 2-8°C 3 个月 |
IMP-MK003F | 小鼠肝星状细胞消化液 | 100 mL | 2-8°C 3 个月 |
IMP-MK003G | 小鼠肝星状细胞消化终止液 | 500 mL | 2-8°C 3 个月 |
IMP-MK003Q | 细胞洗液 | 500 mL*2 | 2-8°C 3 个月 |
IMP-MK003D | 细胞纯化分离液 | 100 mL | 2-8°C 6 个月 |
IMP-MK003E | 细胞纯化分离稀释液 | 200 mL | 2-8°C 6 个月 |
IMP-MK003A | Ⅰ 型鼠尾胶原蛋白 | 20 mL | 2-8°C 3 个月 |
IMP-MK00301 | 肝星状细胞贴壁专用培养基 | 100 mL | 2-8°C 3 个月 |
IMP-MK00302 | 肝星状细胞专用完全培养基 | 250 mL | 2-8°C 3 个月 |
分离步骤
实验前准备:将小鼠肝星状细胞灌注液Ⅰ、灌注液Ⅱ、消化液置于水浴锅中加热至 37℃, 备 用。实验需自备蠕动泵(若无蠕动泵,选择方案二,但效果不如方案一好)、注射器、静脉留置针、 手术器械、75 μm 过滤筛、培养皿、离心管若干。
一、培养皿包被
1.预先用 Ⅰ 型鼠尾胶原蛋白(以下简称鼠尾胶)铺至培养器皿底部包被 0.5-2 h(最长不超过 6
h),吸尽鼠尾胶,鼠尾胶可回收使用 1-2 次。
2.使用 PBS 清洗皿底后吸去 PBS,备用。
二、肝脏消化
方案一:
1.麻醉并且固定小鼠,酒精喷洒清洗腹部。
2.将蠕动泵的软管冲洗完毕后,软管一端置于预热好的肝星状细胞灌注液Ⅰ内,软管另一端与静 脉留置针相连接并设置好灌流速度为 5 mL/min。
3.剪开小鼠腹腔,沿肝脏上方剪开胸腔隔膜,使上腔静脉暴露,用止血钳夹住上腔静脉。
4.拨开小鼠肠组织,暴露小鼠下腔静脉和肝门静脉,在下腔静脉的位置插入静脉留置针并固定好 位置,轻轻拔出针芯,拔出时针管处有回血,此时外套软管留在血管内,启动蠕动泵进行灌注。
5.当见到肝脏充盈,立即剪开门静脉引流,保持至排尽肝脏内血液、肝组织呈现蜡黄色为止。
6.换上肝星状细胞灌注液 II,将灌流速度改为 3 mL/min。并用棉签节律性按压门静脉切口(挤压 5-10s 左右,间隔 30 s-1 min,让肝脏略微充盈,提高消化率),消化肝脏直至用棉签按压肝脏有塌陷 感或者部分透明感,条纹样的裂纹。
7.将肝脏沿着膈肌周围整个剪下来置于装有细胞洗液的培养皿中,转移到超净台中清洗一遍。将 清洗后的肝脏组织转移至新的装有小鼠肝星状细胞消化液的培养皿,用镊子小心去除胆囊和肝脏外的 包膜,轻轻撕裂肝组织使肝脏混合细胞散落至培养皿中,未完全分散的部分及肝总管用镊子轻轻拨碎 至肝星状细胞消化液中。
8.将培养皿中的肝混合细胞及消化液收集于 50mL 离心管中,37℃水浴消化 20 分钟。
9.用 3-4 倍体积的细胞消化终止液终止消化。
方案二:
1.麻醉并且固定小鼠,酒精喷洒清洗腹部。
2.将装有肝星状细胞灌注液Ⅰ的注射器的射端(不需要用到针头)与静脉留置针相连接。
3.剪开小鼠腹腔,沿肝脏上方剪开胸腔隔膜,使上腔静脉暴露,用止血钳夹住上腔静脉。
4.拨开小鼠肠组织,暴露小鼠下腔静脉和肝门静脉,在下腔静脉的位置插入静脉留置针并固定好 位置,轻轻拔出针芯,拔出时针管处有回血,此时外套软管留在血管内,手推压注射器进行灌注,保持 灌流速度为 5 mL/min。
5.当见到肝脏充盈,立即剪开门静脉引流,保持至排尽肝脏内血液、肝组织呈现蜡黄色为止。
6.换上肝细胞灌注液 II,将灌流速度改为 3 mL/min。并用棉签节律性按压门静脉切口(挤压 5- 10s 左右,间隔 30 s-1 min,让肝脏充盈,提高消化率),消化肝脏直至用棉签按压肝脏有塌陷感或者部 分透明感,条纹样的裂纹。
7.将肝脏沿着膈肌周围整个剪下来置于装有细胞洗液的培养皿中,转移到超净台中清洗一遍。将 清洗后的肝脏组织转移至新的装有小鼠肝星状细胞消化液的培养皿,用镊子小心去除胆囊和肝脏外的 包膜,轻轻撕裂肝组织使肝脏混合细胞散落至培养皿中,未完全分散的部分及肝总管用镊子轻轻拨碎 至肝星状细胞消化液中。
8.将培养皿中的肝混合细胞收集于 50mL 离心管中,37℃水浴消化 20 分钟。
9.用 3-4 倍体积的细胞消化终止液终止消化。
三、肝星状分离纯化
1. 用细胞洗液润洗 75 μm 筛网,将上述步骤中的培养皿内的细胞浊液用宽头吸头或者巴氏管移 至筛网上方过滤。
2. 4℃, 600 xg 离心 10 分钟。
3. 弃去上清,用细胞洗液进行重悬,离心:4℃, 50 xg ,10 分钟。
4. 吸取大部分上清至新的离心管中(细胞沉淀为肝实质细胞),将细胞悬液进行离心:4℃, 50 xg,10 分钟。
5. 吸取大部分上清至新的离心管中(细胞沉淀为肝实质细胞),将细胞悬液进行离心:4℃, 600 xg,10 分钟。
6. 弃去上清,用 4mL 细胞洗液重悬细胞。
7. 配置 25% 、50%的活细胞纯化液(如配置25% 细胞纯化液配方为:细胞纯化液:分离纯化稀 释液 = 1:3)。先将 3ml 25%活细胞纯化液加入 15ml 离心管中,再将 3ml 50%的活细胞纯化液加入到 25%活细胞纯化液下面,再将 2ml 细胞悬液小心添加至活细胞纯化液面上,细胞悬液与细胞纯化液间 应产生明显分层。
8. 4 ℃, 1500 xg 离心 25 分钟(使用水平转子,加速度减速度均为最低)。
9. 离心完毕后肝星状细胞处于 25%-50%的活细胞纯化液之间。
10. 收集肝星状细胞至 15ml 离心管中,用细胞洗液填满 15ml 离心管。1500 xg ,5 分钟。
11. 用 3ml 细胞洗液重悬细胞沉淀。1500 xg ,5 分钟。
12. 肝星状细胞贴壁专用培养基重悬细胞沉淀,种板(此时用的为未包被的培养器皿,目的是进一 步纯化肝星状细胞),放细胞培养箱中贴壁 5 分钟,期间可2-3 次取出该培养器皿进行轻轻摇晃,避免 肝星状细胞贴壁。
13. 5 分钟后收集培养基(未贴壁的肝星状细胞),根据实验要求调整细胞密度重新种板。此时使 用包被好的培养皿。
14. 24H 后用 PBS 冲洗 1-2 次以去除残留在皿中的细胞碎片,换成肝星状细胞专用完全培养基以 维持肝星状细胞生长。
注意事项
1. 肝脏灌注液在灌注肝脏过程中需保证温度稳定在 37℃
2. 肝脏离体后建议在冰上操作,分散肝星状细胞时应避免使用尖头吸头、过度重悬等操作导致细 胞机械损伤。
3. 肝脏水浴消化的时间可以根据肝脏灌注情况适当调整,但不建议超过 30 分钟。
4. 添加不同配比活细胞纯化液时应该小心操作,保证不同配比活细胞纯化液间的界线清晰,否则 较难获得细胞。
5. 肝星状细胞为不可增殖不可传代细胞,禁止使用胰酶等消化酶处理肝星状细胞,并在肝星状细 胞稳定贴壁后(24h 后)尽快完成实验。
6. 因分离肝星状细胞的离心转速较高,分离完毕后会有较多杂质和碎片,其属于正常现象。
7. 小鼠肝星状灌注液中含有微生物生长所需的营养成分,请在超净工作台内打开,按照所需要 量分装,并且用封口膜封住瓶口,即取即用,以避免污染。